核心观点:
➢临床现有抗精神病药多针对多巴胺D2及5-HT2A受体,对阴性、认知症状疗效有限,且伴副作用。新型药物聚焦胆碱能靶点以改善这些问题。Karuna的KarXT(作用于M1/M4受体)有望成为全新机制药物,预计2024年9月获FDA批准。Cerevel的Emraclidine(高选择性M4受体调节剂)在Ib期试验中显著改善症状且耐受性良好,正进行II期试验,预计2024年底完成。
➢创新仍是医药领域重要投资主线。
➢上海在医药产业、临床资源、产业资金等方面具备领先优势。此 次上海发布《意见》,明确支持基因与细胞治疗、mRNA、合成生物、 再生医学等前沿赛道,支持人工智能技术赋能药物研发。政策提到切 实投入大量资金,对创新药械公司研发、生产给予支持。并在临床资 源整合利用、缩短评审周期、加快创新产品应用推广、优化投融资环 境、推动国际化等全面支持上海本地及辐射全国创新药械产业发展。
资料来源:太平洋证券《KarXT有望近期获批上市,抗精神病药物市场迎来变革》2024/9/15、中邮证券《上海发布《关于支持生物医药产业全链条创新发展的若干意见》,创新药械产业链迎政策性利好》2024/7/21、德讯证顾整理时间:2024/09/29
风险提示:行业监管政策变化的风险,贸易摩擦的相关风险,市场竞争日趋激烈的风险。
一、KarXT有望近期获批上市,抗精神病药物市场迎来变革
全球抗精神病药物研发进展:精神分裂症作为一种常见的严重精神疾病,多发病于青壮年时期,且具有高复发性和高致残性的特点,往往给患者及其家庭造成沉重的负担。由于其病理机制至今尚未完全明确,相应的新药研发是一个相当复杂且极具挑战性的领域。
临床现有的抗精神病药物主要作用于多巴胺D2受体和/或5-HT2A受体。现有抗精神病药物普遍对阴性症状和认知症状的疗效有限,且长期服用可能导致锥体外系不良反应或内分泌代谢性不良反应,共同导致广泛的未满足临床需求。因此,能够改善认知和阴性症状的胆碱能靶点成为了近年来倍受关注的新型抗精神病药物靶点。
图表:全球抗精神病药物研发进展(II期和Ⅱ期)

资料来源:药融云,太平洋证券整理
根据药融云数据,目前处于III期临床研究的抗精神病类药物共有7类,其中可以用来治疗精神分裂症的药物共有5类;处于II期临床研究的抗精神病类药物共有18类,其中共有9类药物可以用于治疗精神分裂症。
全球首款胆碱能靶点的抗精神病药物有望近期获批上市:与现有抗精神病药物不同,KarunaTherapeutics和BMS联合开发的KarXT(xanomelinetrospium)不依赖多巴胺能或5-HT能通路,其主要作用于中枢神经系统的M1和M4受体,有望成为抗精神病领域数十年来首个全新机制的药物。目前,KarXT处于NDA阶段,预计将于2024年9月底获得FDA批准上市
图表:KarXT的作用机制

资料来源:《Curent Findings **** Potential Mechanisms of KarXT(Xanomeline-Trospium)in Schizophrenia Treatment》太平洋证券整理
KarXT采用外周阻断策略,由xanomeline(M1/M4受体激动剂)和trospium(外周毒蕈碱受体拮抗剂)的固定剂量组合构成。Xanomeline作为M1和M4受体的激动剂,能够激活大脑中的毒蕈碱型乙酰胆碱受体,从而缓解精神分裂症患者的阴性症状,如冷漠、社会驱动力减少,并提高认知能力。同时,它还能改善幻觉和妄想等阳性精神症状。而Trospiumchloride作为毒蕈碱受体拮抗剂,能够抑制Xanomeline在外周神经中的副作用,确保药物的安全性和耐受性。
Cerevel的Emraclidine(CVL-231)是一种高选择性M4受体正向变构调节剂。传统抗精神病药物往往会阻断多巴胺受体并经常导致体重增加、运动问题和镇静等副作用。而Emraclidine通过M4受体间接调节多巴胺,能够显著缓解相关症状,同时最大限度地减少传统抗精神分裂药物的副作用。
在Emraclidine的一项1b期研究中,经过6周的Emraclidine治疗后,患者的阳性与阴性症状量表(PANSS)总分显著改善,具有统计学意义。与接受安慰剂的患者相比,使用Emraclidine的患者的总体耐受性表现良好,未出现严重的不良反应。目前,Emraclidine正在进行两项II期临床试验EMPOWER-1和EMPOWER-2,预计在2024年底完成。
图表:Emraclidine的1b期实验中参与者的PANSS得分变化情况
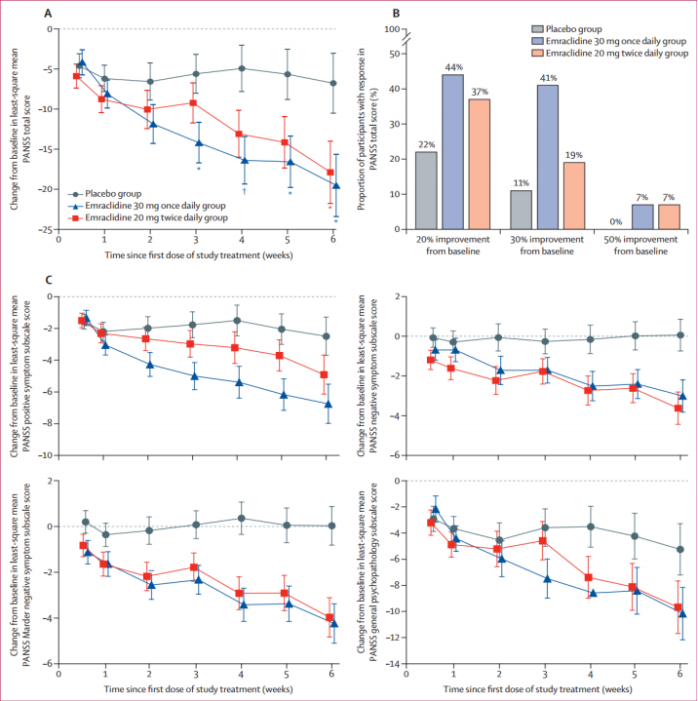
资料来源:《Emraclidine,a novel positive allosteric modulator of cholinergic M4 receptors, for the treatment of schizophrenia : atwo-part,randomised,double-blind,placebo-controlled,phaselbtrial》,太平洋证券整理
NeurocrineBiosciences开发的NBI-1117568是一种高选择性毒蕈碱M4受体激动剂,对其他类型的毒蕈碱受体作用较弱,能最大限度地减少脱靶相关的副作用,提高药物的安全性。2024年8月28日,NeurocrineBiosciences宣布NBI-1117568在精神分裂症成人患者中的II期临床研究中取得积极结果,其20毫克剂量治疗组与安慰剂组相比,在第6周时,阳性和阴性综合征量表(PANSS)总分显著改善7.5分,PANSS总分比基线提高了18.2分,达到主要终点。预计NBI-1117568将于2025年进入III期临床试验。
图表:NeurocrineBiosciences的神经精神病领域在研管线

资料来源:NeurocrineBiosciences官网,太平洋证券整理
图表:替戈拉生韩国销售额
数据来源:inno.N公司官网,中泰证券研究所
二、创新仍是医药领域重要投资主线
1、单品创新,渐入佳境
(1)CNS系列:千亿市场有望孕育多个大单品。相关标的:恩华药业、丽珠集团、苑东生物。
(2)创新医械:从微创新向全面创新稳步迈进。相关标的:微电生理、惠泰医疗、赛诺医疗。
2、出海掘金,拨云见日
(1)创新制药:携手外企打造全球药品发展生态,把握“突破性 确定性”。相关标的:科伦博泰生物-B、乐普生物-B、百奥泰、微芯生物。
(2)体外诊断:产品积累从量变到质变,迈向海外市场开启新征程。相关标的:新产业、亚辉龙、万孚生物、华大智造。
3、设备更新,催化在望
相关标的:迈瑞医疗、联影医疗、开立医疗、澳华内镜、海泰新光、祥生医疗。
三、上海发布《关于支持生物医药产业全链条创新发展的若干意见》,支持创新药械全链条发展
事件:7月30日上海市人民政府办公厅印发《关于支持生物医药产业全链条创新发展的若干意见》,并召开发布会详细解读,文件内容主要包含8方面的37项政策举措。包括:大力提升创新策源能力、推动临床资源更好赋能产业发展、推动审评审批进一步提速、加快创新产品应用推广、加强为企服务和产业化落地支持、强化投融资支持、释放数据要素资源价值、推动产业国际化发展等八个方面。
进一步鼓励创新策源。《意见》指出加大对创新药械研发的支持,鼓励企业开展原始创新,大力培育重磅产品。前瞻布局基因与细胞治疗、mRNA、合成生物、再生医学等前沿赛道,支持人工智能技术赋能药物研发,提供更多智能化应用场景。资金支持包括:推动合同研发机构(CRO)为高校科研院所提供新药临床前研究服务,按照规定给予每个项目年度贴息金额最高1000万元支持。对由我市注册申请人开展国内I期、Ⅱ期、Ⅲ期临床试验并实现产出的1类新药,按照规定对不同阶段择优给予不超过研发投入的40%,最高分别1000万元、2000万元、3000万元支持;对其中仅需完成早期临床试验、确证性临床试验的细胞与基因治疗1类新药,按照规定择优给予最高分别1500万元、3000万元支持。每个单位每年累计支持金额最高1亿元。对进入国家和我市创新医疗器械特别审查程序的产品,按照规定给予最高300万元支持;以上产品首次取得注册证并落地生产的,按照规定再给予不超过研发投入的40%,最高800万元支持。每个单位每年累计支持金额最高3000万元。
进一步放大临床资源优势。《意见》指出持续增设研究型床位,建设功能完备、集约共享的研究型病房。完善临床成果作价入股等转化机制,优化成果评价和团队激励机制。引导保险机构加强对临床试验和产品创新的风险补偿,完善风险共担机制。具体举措包括,缩短临床试验启动时间,建立肿瘤、心脑血管、代谢、精神神经等重大疾病临床试验预备队列,支撑受试者快速入组。争取将临床试验启动前医疗机构内部整体用时压缩至25周以内。支持符合条件的合同研发机构(CRO)对接国际标准开展临床试验服务能力提升项目,按照规定对每个项目择优给予最高100万元支持。对在海外开展高水平创新产品临床试验项目,按照规定择优给予最高2000万元支持。每个单位每年累计支持不超过1亿元。鼓励保险机构开发国内临床试验和产品责任保险、海外临床试验和高端医疗设备责任保险,按照规定对投保企业给予实际缴纳保费的50%,最高分别50万元、100万元支持。
进一步缩短审评审批周期。《意见》指出推动实施国家注册审评审批改革试点,实现药品补充申请审评时限压缩至60个工作日、药物临床试验申请审评审批时限压缩至30个工作日。加快第二类医疗器械审评,将审评平均时限压缩至40个工作日以内。
进一步加快创新产品应用推广。《意见》指出推动更多“新优药械”入院、入医保,确保上海市医疗机构“应配尽配”。加大创新产品医保支付力度,对相关诊疗项目实行医保预算单列支付、在DRG/DIP即疾病诊断相关分组/病种分值改革中单独支付,提高支付标准、不受高倍率病例数限制。大力支持上海市创新药械国际化发展。支持医疗机构与企业合作开展创新药械应用示范项目,进行上市后评价、真实世界疗效评价、适应症拓展等研究,按照规定择优给予每个项目最高200万元支持。
进一步完善全要素支撑体系。《意见》指出强化投融资支持,发挥生物医药产业母基金、股权投资基金、创新转化基金等作用,加强战略纾困投资。鼓励企业风险投资,设立产业并购基金,支持企业并购重组、做大做强。释放数据要素价值,推动队列研究数据开放共享,打造高质量语料库和行业数据集,推动行业数据依法合规交易、跨境安全流动。推出500万方标准化厂房,保障重大产业项目加快落地。
进一步强化投融资支持。《意见》指出发挥上海生物医药产业母基金、生物医药产业股权投资基金和生物医药创新转化基金作用,对潜力企业和优质研发管线加强战略纾困投资。鼓励政府引导基金“投早投小投硬科技”。鼓励开展企业风险投资(CVC),对符合条件的CVC给予市属国资和产业母基金出资、基金设立快速通道等支持。
进一步释放数据要素资源价值。《意见》指出建立队列研究数据开放共享机制,完善医疗医保数据资源合作利用机制,打造高质量语料库和行业数据集以及推动行业数据安全合规流动。
进一步推动产业国际化发展。《意见》指出加大创新产品全球注册认证支持力度。对我市企业研发的创新药、现代中药和高端医疗器械,申请通过美国国家食品药品监督管理局(FDA)、欧洲药品管理局(EMA)、欧洲共同体(CE)、日本药品和医疗器械管理局(PMDA)或世界卫生组织以及金砖国家、“一带一路”国家药品监管机构注册,并在当地实现销售的,按照规定择优给予不超过研发投入的30%,最高1000万元支持。对于首付款1亿元以上的海外权益许可交易(双方应无投资等关联),按照规定择优给予出让企业不超过其第三方等专业服务投入的50%,最高500万元支持。
图表:国家及地方创新药支持政策频出

资料来源:各地方医保局、发改委、工信局、国常会、上海市人民政府、中邮证券研究所
研究承诺
本报告所采用的数据均来自合法合规渠道,通过合理判断得出结论,独立、客观地出具本报告。承诺遵守国家法律、法规及证券监管机构、行业自律组织的各项规章制度,恪守独立诚信、谨慎客观、勤勉尽职、公正公平的原则,为投资者提供专业服务。
投资评级说明
评级标准
概念标的:相对强于市场基准指数收益率5%~15%之间;
中性:相对于市场基准指数收益率介于-5%~ 5%之间;
回避:相对弱于市场基准指数收益率5%以上。
文章内容仅供参考,不构成投资建议!(25)

未经允许不得转载:财富在线 » 【行业跟踪】抗精神病药物市场迎来变革